Il nucleo atomico - la Radioattivita'
La scoperta di Becquerel
La scoperta della radioattività avvenne all'inizio dell'anno 1896 per opera del fisico francese Henri Becquerel in modo accidentale.
Becquerel studiava i raggi X, che soltanto due mesi prima erano stati scoperti da Röntgen.
Uno dei campioni utilizzati da Becquerel era costituito da un sale d'uranio. Sulla lastra fotografica coperta da due strati di cartoncino nero per proteggerla dai raggi diretti del sole, egli metteva appunto uno strato di tale sostanza fosforescente, ed esponeva il tutto alla luce solare per parecchie ore. Quando poi andava a sviluppare la lastra, trovava sul negativo il disegno annerito della crosta di sale d'uranio.
Ma accadde nel frattempo che egli facesse una scoperta accidentale: ... il 26 ed il 27 febbraio [1896], mentre io procedevo nelle esperienze del tipo di quelle ricordate sopra, il sole si mostrava solo a tratti, e quindi decisi di riporre tutto quanto dentro un cassetto, con la crosta di sale d'uranio là dove si trovava. E siccome il sole non si fece vivo per parecchi giorni, il 1° marzo decisi di sviluppare le lastre fotografiche, aspettandomi di trovare delle immagini molto tenui. Al contrario, le silhouette erano assai marcate. Immediatamente mi resi conto che l'azione era in grado di continuare anche al buio. Successivi esperimenti confermarono questa sorprendente ipotesi.
La radiazione dell'uranio assomigliava ai raggi X da due importanti punti di vista:
- per il potere di penetrazione, e di ionizzazione.
- erano invisibili all'occhio, ma potevano impressionare lastre fotografiche.
Tuttavia, i raggi X ed i raggi di Becquerel differivano per almeno due importanti aspetti:
- i raggi dell'uranio non avevano necessità di un dispositivo quale il tubo a raggi catodici, e nemmeno della luce, per essere generati,
- la loro emissione non poteva essere in alcun modo impedita.
I problemi fondamentali da risolvere erano due:
- quale fosse la sorgente di energia che generava i raggi dell'uranio e che rendeva possibile la loro penetrazione attraverso sostanze opache;
- se vi erano altri elementi, tra i settanta e passa che allora si conoscevano, con proprietà analoghe a quelle dell'uranio.
Il primo problema non trovò soluzione per lungo tempo, mentre il secondo fu risolto dai Curie, all'inizio del 1898.
Altri elementi radioattivi Uno dei colleghi di Becquerel che lavoravano in quel tempo a Parigi, era Pierre Curie, il quale si era da poco sposato con Marie Sklodowska, polacca di nascita, e anch'essa di professione fisico. Marie Curie si dedicò allo studio sistematico dei raggi di Becquerel, cercando di scoprire l'esistenza dì altri elementi capaci di emettere tali raggi. Una sua prima scoperta fu che l'elemento torio ed i suoi composti emettevano radiazioni aventi proprietà analoghe a quelle dei raggi dell'uranio.
Nel luglio del 1898, i Curie ottennero un prodotto sconosciuto al quale essi proposero di attribuire il nome di polonio, in onore della patria di Marie Curie. Sei mesi dopo la scoperta del polonio, i coniugi Curie trovarono un nuovo elemento che essi chiamarono radio di massa atomica pari a 225.
Uno dei principali problemi da risolvere, consisteva nello stabilire la natura delle misteriose radiazioni emesse dai corpi radioattivi.
Nel 1899, Ernest Rutherford, trovò che l'uranio emetteva almeno due diversi tipi di raggi, uno che viene assorbito molto facilmente dalla materia (che chiamò raggi alfa) e l'altro più penetrante (che chiamò beta). Nel 1900 il fisico francese Villard identificò, utilizzando il radio, un terzo tipo di radiazione ancora più penetrante che fu chiamata gamma.
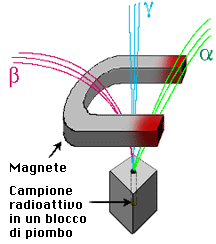
La carica e la massa dei raggi alfa, beta e gammaLe radiazioni di Becquerel vennero fatte passare entro un campo magnetico perpendicolare per vedere se subivano deviazioni o meno. Quando infatti un corpuscolo carico elettricamente si muove con velocità v entro un campo magnetico B uniforme e perpendicolare, il corpuscolo risente di una forza la cui intensità, costante, vale F = qvB, e la cui direzione si mantiene sempre perpendicolare al vettore velocità. Tale forza F agisce quindi da forza centripeta, facendo descrivere al corpuscolo un arco di cerchio, il cui raggio r è determinato dalla relazione:
\[q\overrightarrow{v}\times\overrightarrow{B}=m\frac{\overrightarrow{v}^2}{r}\] che esprime sostanzialmente la seconda legge della dinamica.
Incontrando un forte campo magnetico perpendicolare ed uniforme, i tre tipi di raggi si separano.
- I raggi gamma non mostrano alcuna deviazione, e proseguono in linea retta. Dovevano essere quindi neutri, ma da ciò non si poteva tuttavia concludere se essi avessero o meno natura corpuscolare.
- I raggi beta vengono deviati allo stesso modo dei raggi catodici studiati da Thomson. Ciò portò alla conclusione che erano costituiti da particelle cariche negativamente. Il rapporto q/m (carica / massa) concluse che erano elettroni.
- I raggi alfa vengono deviati in verso contrario dovendo pertanto essere necessariamente costituiti da particelle cariche positivamente. Il rapporto q/m per le particelle alfa era di circa 4000 volte più piccolo.
Rutherford dimostrò che la particella alfa era un atomo di elio ionizzato due volte, cioè un nucleo di elio.
Da tale scoperta si poteva concludere che: un atomo (il radon) era in grado di emettere un frammento di se stesso (la particella alfa), il quale frammento si dimostrava esser a sua volta un altro elemento chimico (l'elio).
Trasformazioni radioattiveUn atomo radioattivo emette un frammento e non resta pertanto inalterato dopo l'emissione. Il processo di emissione alfa porta ad un nuovo elemento chimico, al posto dell'elemento radioattivo originale. Ciò avviene anche nel caso dell'emissione beta.
Conclusione: gli atomi degli elementi radioattivi possono scindersi. L'atomo non può più essere considerato come indivisibile.
Un altro importante problema era legato al fatto che i raggi emessi dalle sostanze radioattive trasportavano una notevole quantità di energia. L'origine di questa energia andava perciò ricercata in un qualche cambiamento profondo all'interno degli atomi radioattivi, piuttosto che nelle reazioni chimiche tra gli atomi.
Rutherford e Soddy avanzarono l'ipotesi che, quando un atomo emette una particella alfa o beta, esso si spezza in due frammenti, la particella alfa o beta nonché il residuo dell'atomo originale, il quale risulta essere un atomo avente differenti proprietà fisiche e chimiche, rispetto all'atomo radioattivo che l'ha generato.
Le trasformazioni radioattive possono perciò essere rappresentate con una simbologia analoga a quella che si usa per le reazioni chimiche. Per esempio, possiamo esprimere la trasformazione radioattiva di cui sopra, nella seguente maniera:
\[Ra\rightarrow Rn + He\]
Tale trasformazione può essere indicata anche col termine di «disintegrazione» o «decadimento» o «trasmutazione» del radio in radon, con emissione di una particella alfa.
Famiglie radioattiveIl decadimento del radio e dei suoi discendenti porta a un prodotto finale stabile, che venne identificato in base alle sue proprietà chimiche e risultò essere piombo.
La serie comprendente il radio annovera altri numerosi membri, alcuni dei quali si sono rivelati essere emettitori alfa altri beta. I raggi gamma vengono anch'essi emessi da alcuni di questi elementi, ma sempre assieme a particelle gamma o beta. [vedi schema di decadimento]
Rutherford e Soddy avanzarono l'ipotesi secondo cui, poiché il radio si trova sempre nei minerali d'uranio, il radio stesso avrebbe potuto essere non il capostipite, bensì un discendente della famiglia che ha come primo membro l'uranio.
Ogni atomo d'uranio, cioè, si trasforma nel tempo, ed alla sesta generazione compare il radio, mentre il piombo stabile compare dopo molte altre generazioni.
Ogni membro di una famiglia radioattiva differisce, se pur di poco, sia per le proprietà fisiche, sia per le proprietà chimiche, ed è possibile perciò separare i diversi elementi radioattivi presenti in un certo campione.
Tempo di dimezzamentoSi può enunciare la legge fondamentale del decadimento radioattivo nel modo seguente: la probabilità che un certo atomo decada in un dato intervallo di tempo è proporzionale all'intervallo stesso e la costante proporzionalità, avente le dimensioni dell'inverso di un tempo, detta costante di disintegrazione, è caratteristica della sostanza data e del tipo di decadimento.
L'applicazione più semplice di questa legge si ha nel caso di una singola sostanza radioattiva composta inizialmente da un numero di atomi N(0). La diminuzione del numero degli atomi nel tempo data da:
\[N(t) = N_0 e^{-\lambda t}\]
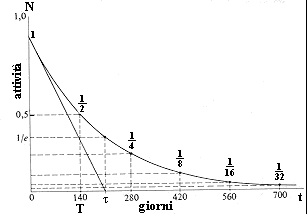
In pratica, oltre alla costante di disintegrazione, viene spesso usato il suo inverso, detto vita media, cioè il tempo entro cui il numero di atomi inizialmente presenti si dimezza, detto tempo di dimezzamento.