Verso la fisica dei quanti
Scoperta dell'elettrone
Nel corso del diciannovesimo secolo la maggior parte degli scienziati riteneva sufficientemente suffragata dagli esperimenti l'ipotesi della costituzione atomica della materia. Rimaneva tuttavia aperto il seguente problema se gli atomi fossero veramente indivisibili, oppure se a loro volta fossero costituiti da particelle ancora più piccole.
Nel 1855, il fisico tedesco Heinrich Geissler inventò una pompa a vuoto in grado di aspirare il gas contenuto in un tubo di vetro fino a ridurne la pressione allo 0,01 per cento della normale pressione atmosferica. Julius Plücker, un amico di Geissler, collegò a una batteria uno dei tubi a vuoto e con sua grande sorpresa trovò che si verificava un passaggio di elettricità nel tubo. Notò pure che, quando una corrente elettrica passa in un tubo contenente gas a bassa pressione, il tubo stesso si illumina di una pallida luminescenza verde.
Un altro fisico, Eugen Goldstein chiamò raggi catodici queste radiazioni di cui si ignorava completamente la natura. Si conoscevano però le seguenti proprietà:
- si propagano in linea retta;
- vengono deviati da un campo magnetico, a differenza di quanto avviene per la luce.
Nel 1897, con una serie di esperimenti, J. J. Thomson dimostrò che i raggi catodici sono particelle con carica negativa. Egli trovò inoltre che il valore di q/m (rapporto tra la carica e la massa) è lo stesso anche per raggi provenienti da catodi di materiale diverso ed è precisamente 1,76 x 1011 coulomb/kg. In questo modo risultò chiaro che i raggi catodici sono particelle in qualche modo comuni a tutti i materiali. Queste particelle furono in seguito chiamate elettroni.
Negli anni tra il 1909 e il 1916, il fisico americano Robert A. Millikan riuscì a misurare la carica dell'elettrone.
Thomson trovò che q/m = 1,76x 1011 coul/kg m
Secondo l'esperienza di Millikan qe = 1,6x 10-19 coul.
Quindi la massa di un elettrone è
\[m=\frac{1,6\times10^{-19} Coul}{7,76\times10^{11} Coul/kg}=0,91\times10^{-30} kg\]
L'effetto fotoelettrico
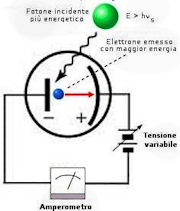 Nel 1887 il fisico tedesco Heinrich Hertz, cercando di verificare sperimentalmente la teoria elettromagnetica di Maxwell, notò che una superficie metallica colpita da luce di lunghezza d'onda molto piccola può emettere cariche elettriche. Questo fenomeno venne chiamato effetto fotoelettrico poiché in esso intervengono sia la luce, sia l'elettricità. Quando le cariche elettriche così prodotte attraversano campi elettrici e magnetici, subiscono le stesse deviazioni dei raggi catodici. Si dedusse perciò che si trattava di particelle con carica negativa.
Nel 1887 il fisico tedesco Heinrich Hertz, cercando di verificare sperimentalmente la teoria elettromagnetica di Maxwell, notò che una superficie metallica colpita da luce di lunghezza d'onda molto piccola può emettere cariche elettriche. Questo fenomeno venne chiamato effetto fotoelettrico poiché in esso intervengono sia la luce, sia l'elettricità. Quando le cariche elettriche così prodotte attraversano campi elettrici e magnetici, subiscono le stesse deviazioni dei raggi catodici. Si dedusse perciò che si trattava di particelle con carica negativa.
Questo fenomeno presenta le seguenti caratteristiche:
- ha luogo solo se la frequenza della radiazione incidente, n, supera un certo valore n0, caratteristico del metallo usato, e detto "soglia" fotoelettrica
- gli elettroni escono dal metallo con velocità che vanno da 0 ad una vmax; l'energia associata a tale vmax dipende dalla frequenza incidente; in particolare E = h(ν - ν0)
Per spiegare questo fenomeno Einstein riprese e sviluppò, su nuove basi concettuali, l'ipotesi dei "quanti di radiazione" di Planck.
La teoria di Einstein
L'interpretazione dell'effetto fotoelettrico fu il lavoro principale che fece assegnare ad Albert Einstein, nel 1921, il premio Nobel per la fisica.
Secondo le ipotesi formulate da Eínsteín, l'energia luminosa non sarebbe distribuita in modo uniforme su tutto il fronte dell'onda che avanza (come si suppone nella teoria classica), ma sarebbe invece concentrata in pacchetti separati; queste quantità di energia così localizzate non avrebbero un valore qualsiasi, ma sarebbero quantità ben definite e proporzionali alla frequenza n dell'onda. Il fattore di proporzionalità è una costante, indicata con h, e nota come costante di Planck.
Il fenomeno è pensato come un processo d'urto fra i quanti di radiazione (fotoni) e gli elettroni del metallo. Pertanto un atomo colpito da un fotone riceve tutta in una volta l'energia hn. Un elettrone potrà essere emesso se tale energia è maggiore del lavoro necessario a strapparlo dal metallo e a fornirgli la necessaria energia cinetica per uscire. Einstein attribuì ai fotoni anche una quantità di moto p = h/λ.
Per verificare sperimentalmente le previsioni di Einstein ci vollero oltre dieci anni di misure sempre più accurate. Solo nel 1916 Robert Millikan ne dimostrò la validità.
L'atomo
Le conoscenze di fisica e di chimica, acquisite all'inizio del ventesimo secolo, erano sufficienti per permettere l'elaborazione di modelli atomici. Si sapeva che particelle negative con identiche proprietà (cioè elettroni) potevano essere ottenute da molte sostanze diverse e in diversi modi. Ciò suggerì l'ipotesi che gli elettroni entrino a far parte di tutti gli atomi. Ma gli elettroni hanno carica negativa mentre un campione qualsiasi di un elemento o di una sostanza è, normalmente, elettricamente neutro e quindi anche gli atomi di cui è costituito tale campione sono presumibilmente neutri. Di conseguenza la presenza di elettroni negativi in un atomo richiederebbe anche la presenza di una uguale quantità di carica positiva.
Conseguentemente ogni modello atomico deve tener conto delle seguenti informazioni:
- un atomo elettricamente neutro contiene uguali quantità di carica positiva e negativa,
- la carica negativa è associata solo a una piccola parte della massa atomica.
Le domande alle quali ogni modello doveva dare una risposta sono dunque almeno due:
- quanti elettroni ci sono in un atomo,
- come sono distribuiti gli elettroni e la carica positiva nell'atomo.
Fino al 1911, il modello atomico più noto fu quello proposto nel 1904 da J. J. Thomson. Secondo questo modello, l'atomo sarebbe formato da una sfera di elettricità positiva nella quale si distribuisce una uguale quantità di carica negativa, sotto forma di elettroni: cioè, una specie di panettone di elettricità positiva con la carica negativa sparsa all'interno come i canditi. Il «fluido» positivo avrebbe dovuto agire sulle cariche negative trattenendole nell'atomo per mezzo di sole forze elettriche, ma non si specificava che cosa forniva coesione al fluido positivo. Per quanto riguarda le dimensioni dell'atomo, si assegnava al raggio un valore dell'or dine di 10-10 m, basandosi su informazioni ottenute dalla teoria cinetica dei gas e da altre considerazioni.