LA FISICA NUCLEARE: ISOTOPI
Famiglia dell'Uranio
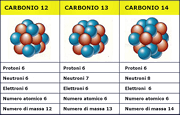
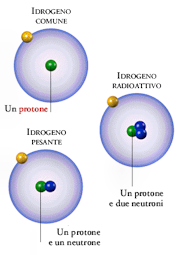
Soddy introdusse il termine di isotopo per indicare atomi avente lo stesso numero atomico Z e diverso numero di massa A.
L'uranio ad esempio ha tre isotopi principali: U238, U2235 e U234. Molti altri elementi, pur non essendo radioattivi, sono anch'essi costituiti da miscuglio di isotopi.
Notazione : 92U238 dove 92 è il numero atomico (Z), 238 il numero di massa (A).
Ci si trovava ora di fronte al problema di spiegare perché avvenivano delle trasformazioni chimiche quando gli atomi si disintegravano.
La risposta a questi problemi venne data attorno al 1913 ancora da Soddy proponendo due leggi che tenevano conto di tutte le osservazioni sperimentali sulla radioattività naturale.
Leggi dello spostamento radioattivo:
- Quando un nucleo emette una particella alfa, il nuovo nucleo che ne deriva possiede massa atomica minore di 4 unità, e numero atomico minore di 2 unità, rispetto al nucleo originario.
- Quando un nucleo emette una particella beta, la massa atomica resta invariata, mentre il numero atomico aumenta di una unità.
Nell'emissione dei raggi gamma, che a volte accompagna l'emissione alfa e beta resta invariata sia la massa atomica, sia il numero atomico.
[Vedi tabella con decadimento famiglia dell'uranio]
Utilizzando queste leggi dello spostamento, Soddy riuscì a prevedere il posto occupato dai vari atomi (chiamati anche nuclidi) appartenenti a ciascuna serie radioattiva, in base al tipo di emissione.
Fasci dì ioni positivi
Non fu un compito facile dimostrare con esperienze dirette che anche gli elementi stabili possono essere costituiti da un insieme di vari isotopi. Per definizione, infatti, gli isotopi non possono venire separati mediante gli usuali metodi della chimica. Ogni tentativo deve quindi basarsi su qualche proprietà dipendente dalla differenza di massa.
Fu sviluppato un metodo, basato su un'idea di J. J. Thomson che aveva studiato la possibilità di deviare ioni positivi in modo diverso all'interno di un tubo catodico sotto l'azioni di campi elettrici e magnetici, che culminò nella costruzione dello spettrografo di massa, capace di separare atomi con masse diverse. Con tale strumento era possibile misurare sia la massa che la carica degli ioni.
Isotopi stabili dei vari elementi
Gli elementi stabili vanno dal numero atomico 1 (idrogeno) al numero atomico 83 (bismuto). Solo un quarto di essi non sono costituiti da miscugli di isotopi, per cui a questi 83 elementi corrispondono 284 diversi nuclidi, di cui 25 sono instabili, che non derivano quindi dalle famiglie radioattive naturali.
Gli elementi con Z pari tendono ad avere in media più isotopi per elemento di quelli con Z dispari.